Sách bài tập Hóa học 10 Bài 16 Kết nối tri thức: Ôn tập chương 4
Với giải sách bài tập Hóa học 10 Bài 16. Ôn tập chương 4 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 16.
Giải sách bài tập Hóa học 10 Bài 16. Ôn tập chương 4 -Kết nối tri thức
Nhận biết
Bài 16.1 trang 42 SBT Hóa học 10: Trong quá trình oxi hóa – khử, chất nhường electron được gọi là
Lời giải
Đáp án đúng là: A
Trong quá trình oxi hóa – khử, chất nhường electron được gọi là chất khử.
Chất nhận electron được gọi là chất oxi hóa.
Bài 16.2 trang 42 SBT Hóa học 10: Iron có số oxi hóa +2 trong hợp chất nào sau đây?
Lời giải
Đáp án đúng là: C
Lời giải
Đáp án đúng là: B
Số oxi hóa của O thường là -2. Đặt x là số oxi hóa của Cr trong CrO3 ta có:
x.1 + (-2).3 = 0 ⇒ x = +6
Bài 16.4 trang 43 SBT Hóa học 10: Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng
Lời giải
Đáp án đúng là: D
Phản ứng kèm theo sự cho và nhận electron được gọi là phản ứng oxi hóa – khử.
Bài 16.5 trang 43 SBT Hóa học 10: Xét phản ứng điều chế H2 trong phòng thí nghiệm:
Chất đóng vai trò chất khử trong phản ứng là
Lời giải
Đáp án đúng là: D
Zn nhường 2 electron (số oxi hóa tăng từ 0 lên +2) ⇒ Zn là chất khử.
Thông hiểu
Bài 16.6 trang 43 SBT Hóa học 10: Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2.
Số hợp chất chứa nguyên tử nitrogen có số oxi hóa -3 là
Lời giải
Đáp án đúng là: C
Có 2 hợp chất chứa nguyên tử nitrogen có số oxi hóa -3 là NH3, NH4Cl.
Bài 16.7 trang 43 SBT Hóa học 10: Nguyên tử sulfur chỉ thể hiện tính khử trong hợp chất nào sau đây?
Lời giải
Đáp án đúng là: D
Nguyên tử sulfur chỉ thể hiện tính khử trong hợp chất H2S vì hợp chất H2S có số oxi hóa thấp nhất của S là -2. Trong các phản ứng oxi hóa khử, số oxi hóa -2 chỉ có thể tăng, không thể giảm.
Lời giải
Đáp án đúng là: A
C đơn chất có số oxi hóa bằng 0, là số oxi hóa trung gian của C, số oxi hóa này có thể tăng hoặc giảm trong phản ứng oxi hóa khử.
⇒ Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong C đơn chất.
Lời giải
Đáp án đúng là: B
Hợp chất Fe3O4 (có thể viết FeO.Fe2O3), chứa hai loại nguyên tử iron với số oxi hóa +2 và +3.
Bài 16.10 trang 43 SBT Hóa học 10: Cho các phân tử sau: H2S, SO3, CaSO4, Na2S, H2SO4.
Số oxi hóa của nguyên tử S trong các phân tử trên lần lượt là
Lời giải
Đáp án đúng là: D
Vận dụng
a) Xác định các nguyên tử có sự thay đổi số oxi hóa. Viết quá trình oxi hóa, quá trình khử.
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
Lời giải
a)
C là chất khử, ZnO là chất oxi hóa
Quá trình oxi hóa:
Quá trình khử:
b)
Xác định được hệ số của tất cả các chất đều bằng 1
ZnO + C Zn + CO
Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Lời giải
a) 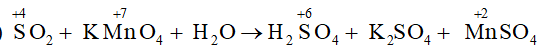
Xác định được hệ số của SO2 là 5, KMnO4 và MnSO4 là 2, sau đó cân bằng nguyên tố S và H tìm được hệ số của H2SO4 là 2, của H2O là 2.
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
b) Theo phương trình hóa học ta có:
= 24,79.0,005 = 0,12395 L = 123,95 (mL)
Bài 16.13 trang 44 SBT Hóa học 10: Thực hiện các phản ứng sau:
Lời giải
Carbon vừa đóng vai trò là chất oxi hóa, vừa đóng vai trò khử trong phản ứng (d):
Quá trình oxi hóa:
Quá trình khử:
Xác định được hệ số của C trong cả hai vai trò chất oxi hóa và chất khử là 3, hệ số của CO là 1:
CaO + 3C CaC2 + CO
a) Tính phần trăm thể tích mỗi khí trong X.
Lời giải
Các phản ứng hóa học:
2Mg + O2 2MgO
Mg + Cl2 MgCl2
4Al + 3O2 2Al2O3
2Al + 3Cl2 2AlCl3
a) Áp dụng định luật bảo toàn khối lượng, ta có: mX = 8,84 – 2,52 = 6,32 (g)
Phần trăm thể tích khí O2 và Cl2 trong hỗn hợp lần lượt là 20% và 80%
b) Số mol electron chất oxi hóa nhận bằng số mol các chất khử đã cho:
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron
Lời giải
a)
Xác định được hệ số của FeS2 là 4, Fe2O3 là 2, O2 là 11 và SO2 là 8:
4FeS2 + 11O2 2Fe2O3 + 8SO2
b)
⇒


